上海芯超生物科技有限公司
19 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
公司新闻/正文
【IF:44.5】多模态空间组学解析肺腺癌微环境变化
1315 人阅读发布时间:2026-01-14 11:18

2025年,空间组学研究已经成为高分发表的必备神器,尤其是以TMA+ Spatial omics 为代表的“芯空一号”模式成为了发文热门。今天小编就为大家分享一篇2026新鲜出炉的“芯空一号”模式的文章,给各位老师一些思路和启发。

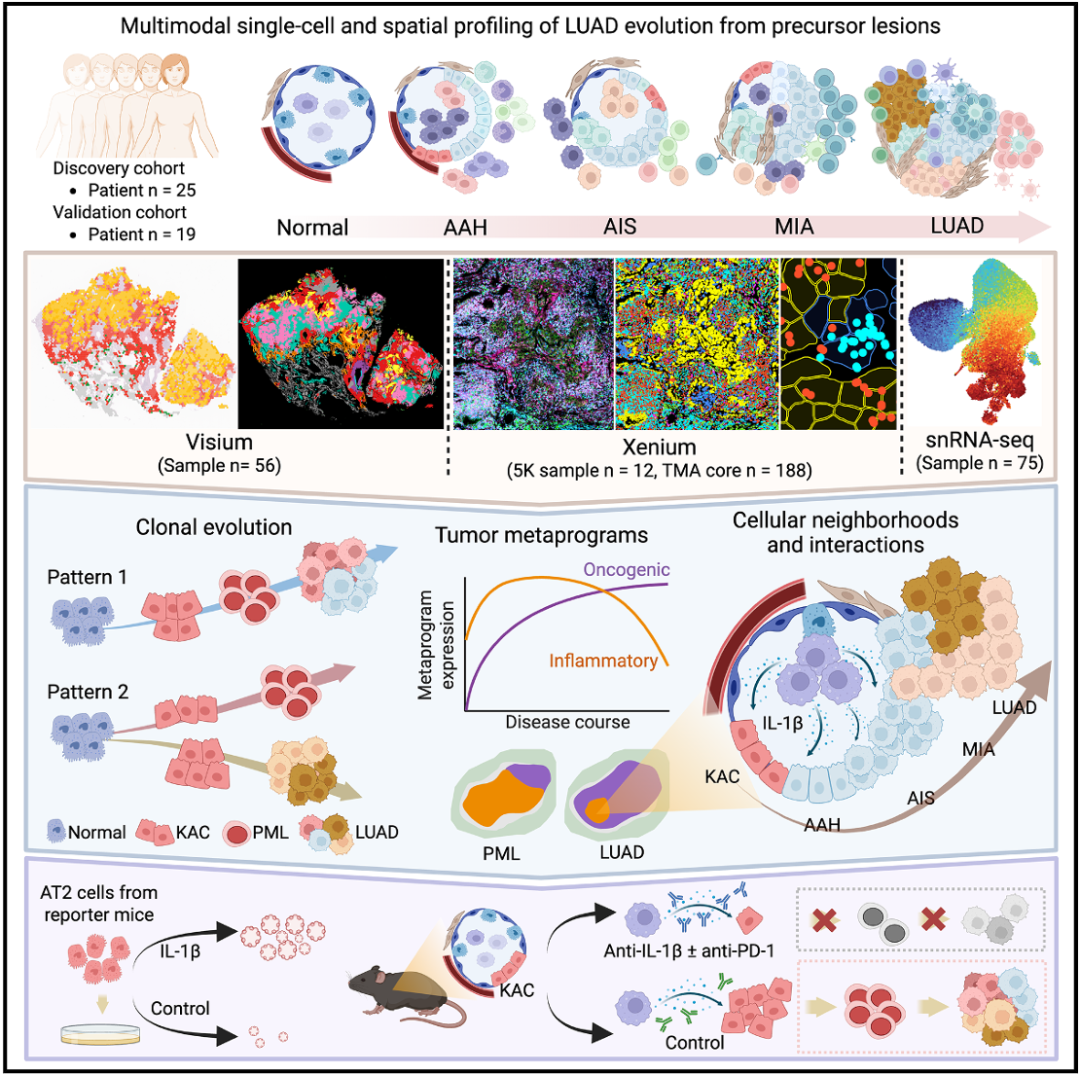
这篇题为《Multimodal spatial-omics reveal co-evolution of alveolar progenitors and proinflammatory niches in progression of lung precursor lesions》的研究,发表于 Cancer Cell(2026),通过整合多模态空间组学技术,系统揭示了肺腺癌(LUAD)从前驱病变向浸润性癌发展过程中,肺泡祖细胞与促炎性微环境的共进化机制。
★
文章思路与逻辑主线
★
本研究围绕一个核心科学问题展开:肺腺癌(LUAD)是如何从其前驱病变(如AAH、AIS)发展而来的,其中细胞微环境与空间结构如何演变?
整体逻辑主线:
1. 问题提出:LUAD的早期发生机制不清,尤其是前驱病变中上皮细胞与免疫微环境的相互作用缺乏空间层面的解析。
2. 技术策略:采用多模态空间组学(Visium空间转录组、snRNA-seq、Xenium单细胞空间转录组、空间CNA推断等),在人源样本与小鼠模型中同步展开分析,实现“分子—细胞—空间—进化”的多维度整合。
3. 机制探索:从空间表达模式→克隆进化→细胞互作→微环境定位→功能验证,逐步揭示肺泡祖细胞(KACs/RPII)在促炎微环境中的关键作用。
4. 临床转化:在动物模型中验证靶向IL-1β信号轴在癌前阶段的干预价值,提出“早期炎症微环境可作为拦截靶点”的治疗新思路。
★
结果梳理与意义
★
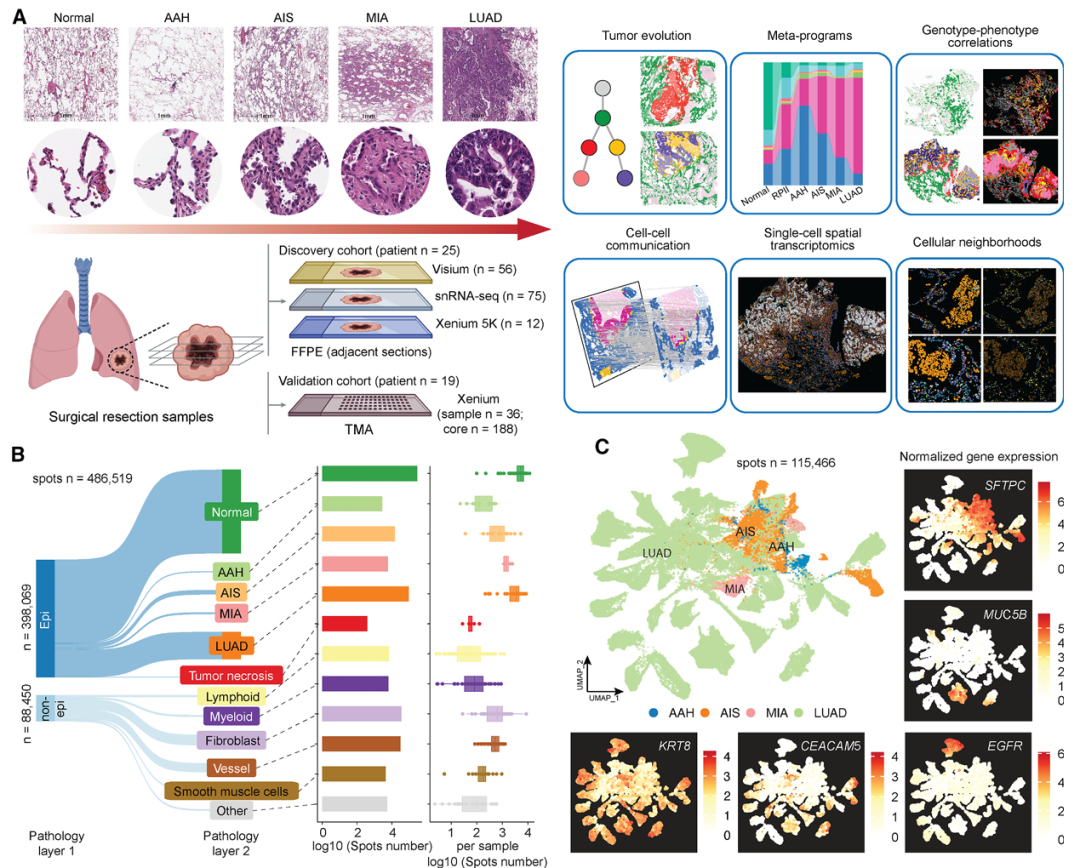
1. 空间转录组揭示前驱病变与LUAD的差异表达模式
结果:
通过Visium分析56例人组织样本,发现AAH/AIS病变区域高表达肺泡II型细胞标志物(如SFTPC),而LUAD区域则高表达去分化与肿瘤相关基因(如KRT8、CEACAM5)。
意义:明确了前驱病变仍保留肺泡特征,而LUAD已发生显著转录重编程,提示肿瘤进展伴随肺泡上皮的去分化。
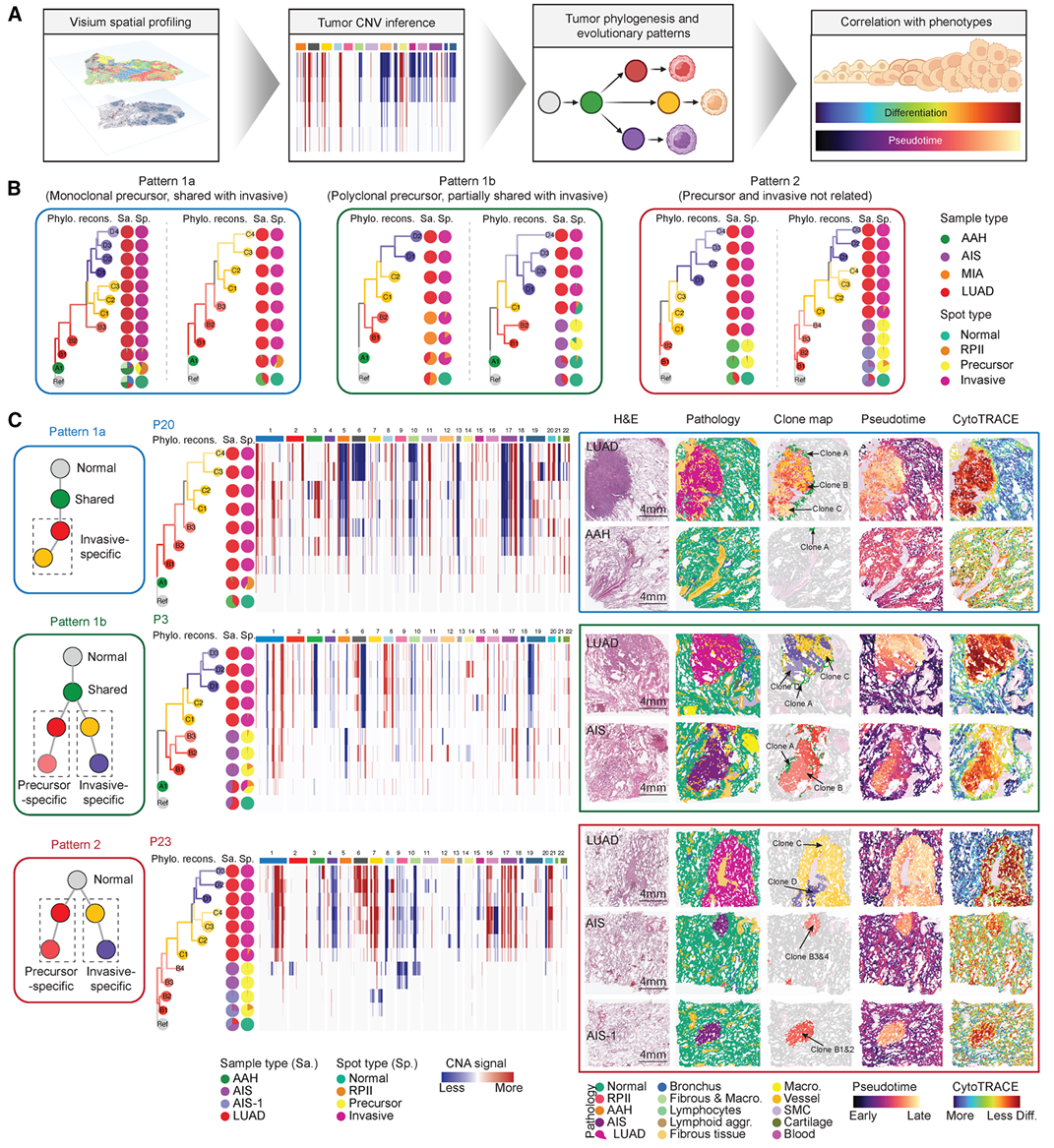
2. 克隆进化分析揭示患者特异性演化路径
结果:
通过SpatialInferCNV推断拷贝数变异,将患者分为三类进化模式(1a,1b,2):
模式1a/b:前驱与浸润病变共享克隆;
模式2:两者无共享克隆(独立起源)。
意义:揭示了LUAD发展路径的高度异质性,部分肿瘤从前驱病变直接演进,部分则可能为新生克隆。
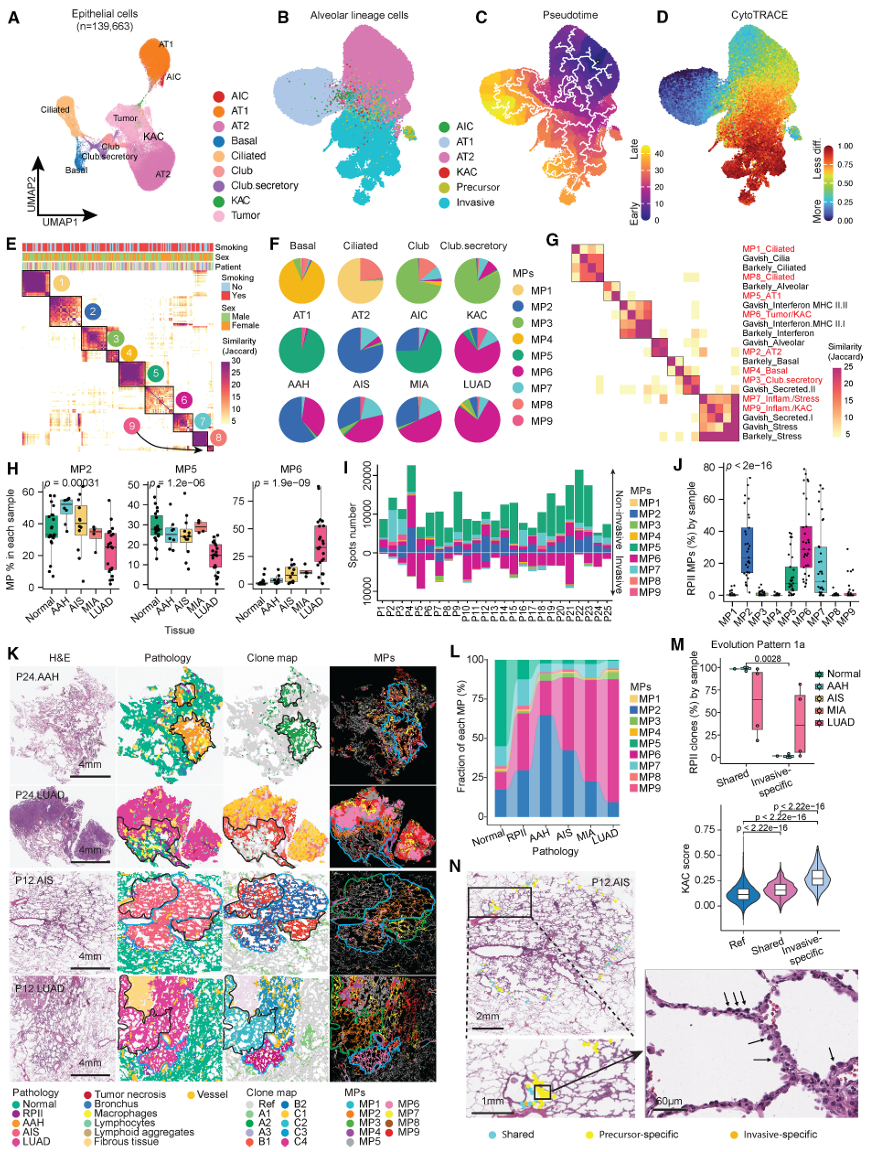
3. 肺泡祖细胞(KACs/RPII)被识别为最早前体
结果:
1.snRNA-seq鉴定出KRT8高表达的肺泡中间细胞(KACs),其转录特征介于AT2与肿瘤细胞之间;
2.空间定位显示KACs对应病理上的反应性II型肺泡上皮细胞(RPII),位于前驱病变边缘。
意义:首次在空间与单细胞层面确认KACs/RPII是LUAD的细胞起源,且其出现早于形态学可识别的病变。
4. 上皮–促炎微环境在前驱病变中富集
结果1:
1.KACs/RPII高表达IL1R1;
2.其周围富集IL1B高表达的巨噬细胞;
3.IL-1β–IL1R1信号在前驱病变中显著活跃,尤其在KRAS突变型病例中。
意义:提示炎症信号(IL-1β)在癌前阶段驱动肺泡祖细胞向肿瘤转化,且该微环境具有阶段特异性(早期富集,晚期减少)。
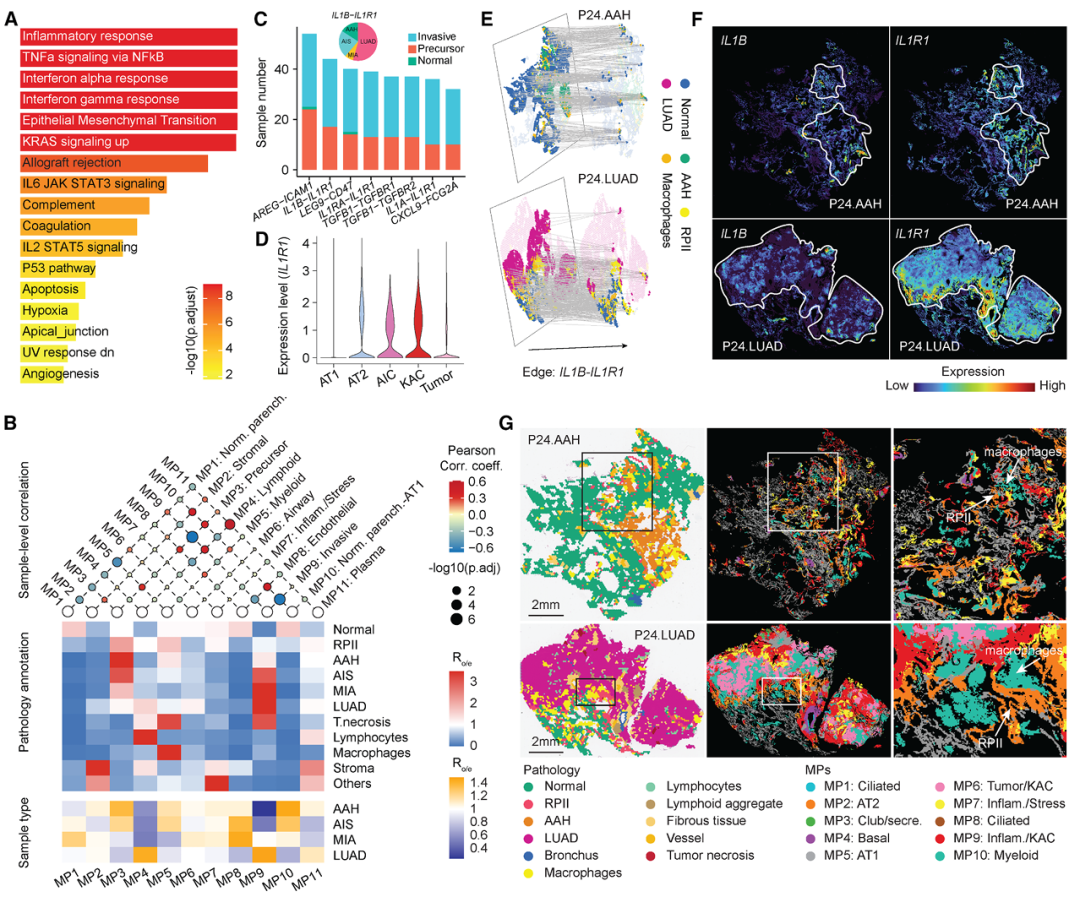
结果2:
使用Xenium平台(5K panel)对进行单细胞原位分析验证,并使用组织芯片大队列(19例早期LUAD患者的肺前体和侵袭性病变(n = 36个样本,共188个核心))精确定位IL1B+巨噬细胞与IL1R1+上皮细胞的空间邻近关系,直观呈现“细胞—微环境”互作。
意义:上皮-促炎微环境不仅参与LUAD的发病机制,而且具有分期特异性,在早期肺前体病变中普遍存在。
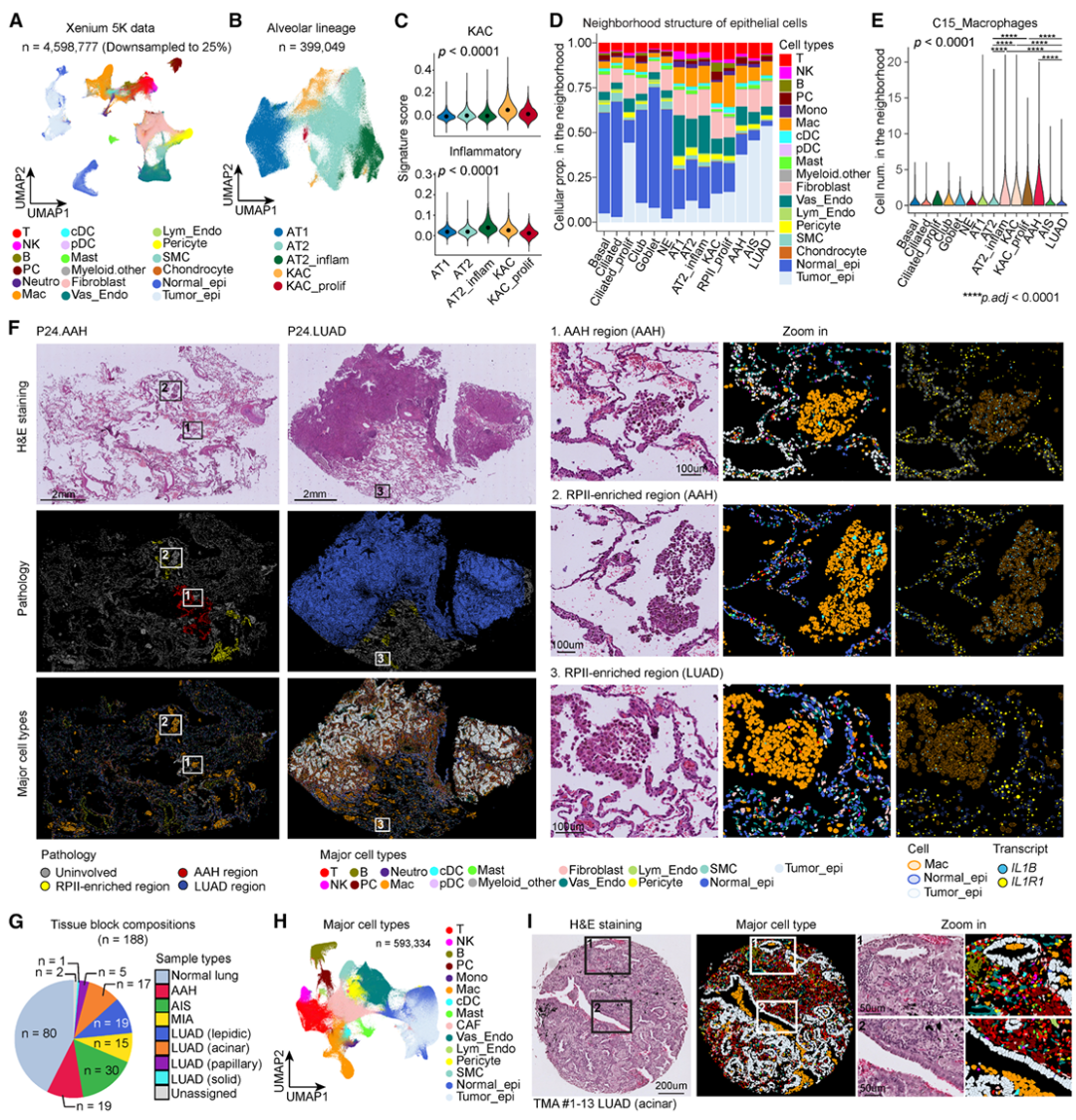
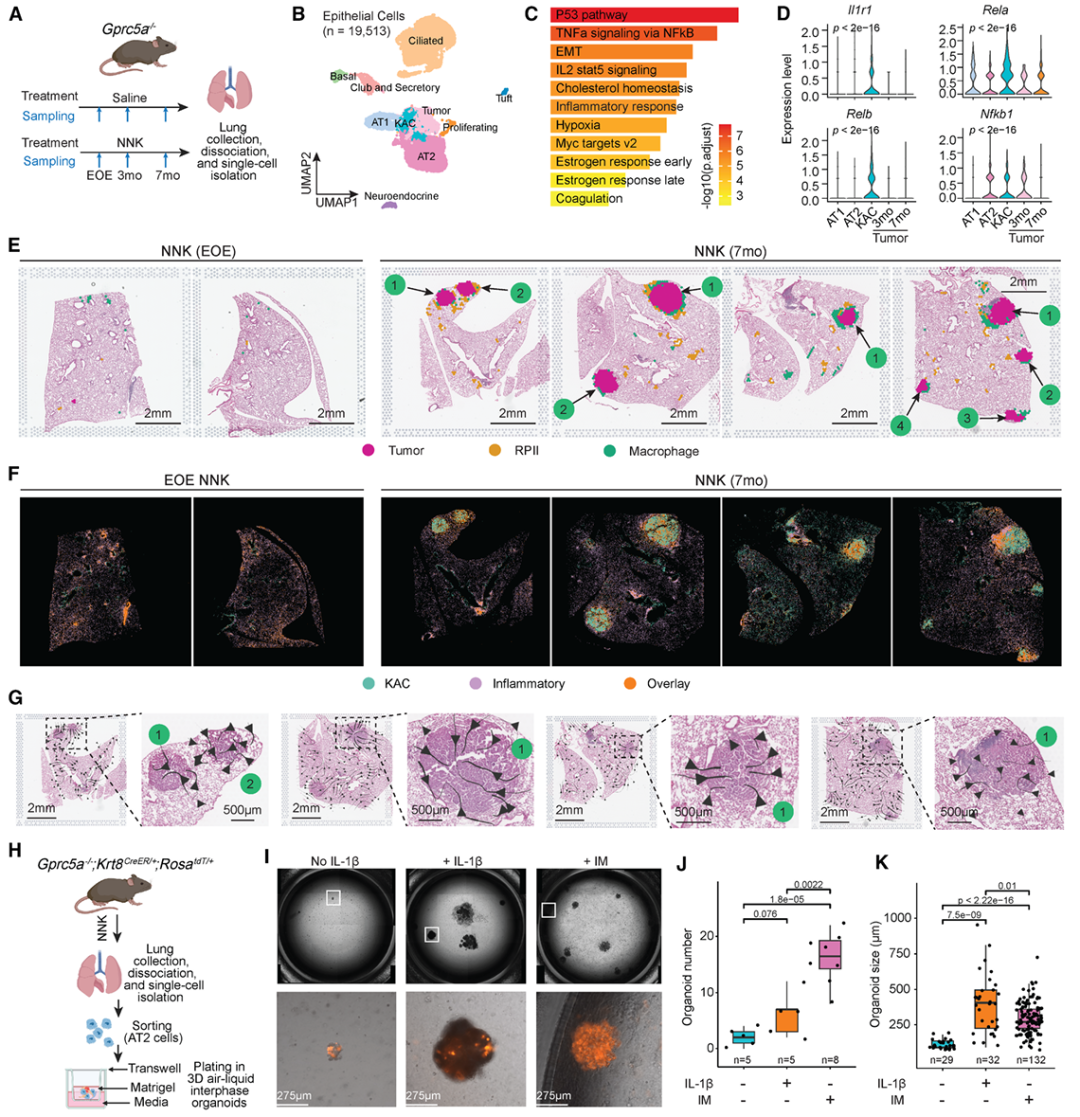
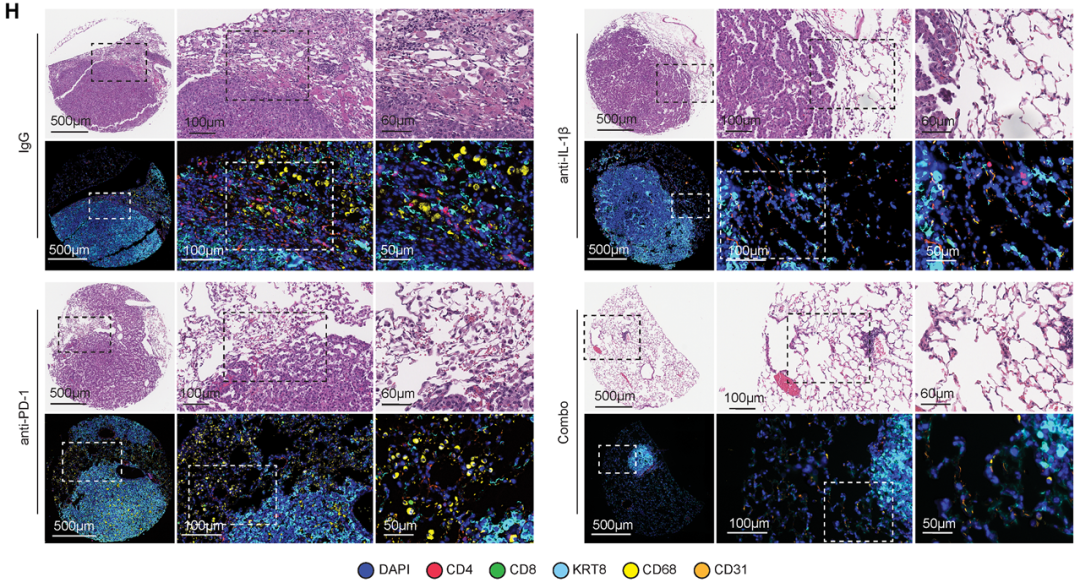
5. 小鼠模型验证机制与治疗潜力
结果:
1.在NNK诱导的LUAD小鼠中,同样观察到KACs富集于巨噬细胞丰富的促炎微环境;
2.敲除 Il1r1 或使用抗IL-1β抗体可显著减少KACs与肿瘤负荷;
3.联合抗IL-1β与抗PD-1治疗在癌前阶段效果最佳。
意义:在癌前阶段通过抑制IL-1β信号传导来靶向炎症可能会破坏肺泡细胞向肿瘤祖细胞的转化,并有效减少LUAD的发病机制,因此在功能上证实了IL-1β信号是驱动早期LUAD发展的关键机制,并为临床早期干预提供了实验依据。
★
总 结
★
本研究通过多模态空间组学的系统性整合,在空间、分子与细胞三个维度上揭示了LUAD早期发展的核心机制:肺泡祖细胞(KACs/RPII)在富含IL-1β的促炎微环境中被激活,逐步演进为肿瘤,且该过程在癌前阶段最为活跃。这不仅深化了对肺癌起源的理解,也为早期拦截治疗提供了新靶点(如IL-1β信号轴)与策略(联合免疫检查点抑制剂)。
★
组织芯片的重要性
★
在这项研究中,组织芯片(TMA)扮演了一个至关重要的角色,它是一种高效、标准化且强大的验证与扩展平台。其作用具体体现在以下三个层面:
1. 作为独立验证队列,增强结论的普适性和可靠性
研究的主要发现(如促炎微环境在前驱病变中富集)是基于一个相对较小的“发现队列”(25名患者的56个组织样本)得出的。
研究者构建了一个包含36个独立样本(来自19名患者)的TMA,并将其作为一个验证队列,使用Xenium单细胞空间技术进行分析。
在TMA这个独立的、空间结构固定的样本集合中,重复观察到了相同的核心现象(例如AAH/AIS病变周围富集IL1B+巨噬细胞)。这极大地增强了研究结论的可靠性,证明其并非偶然发现或批次效应,而是可重复的生物学规律。
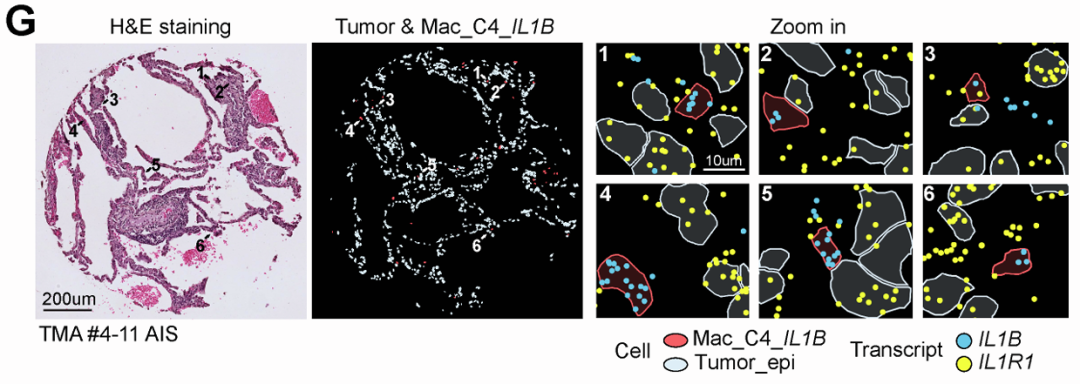
2. 实现稀有样本的高通量、标准化空间分析
肺癌前驱病变(如AAH、AIS)在临床手术标本中体积小、数量稀少,难以获取大量完整的组织切片进行多平台分析。
TMA技术允许将数十个甚至上百个微小组织核心(本研究为188个)精准地排列在一张玻片上。
高效:一次性对来自多个患者的多种病变类型(正常、AAH、AIS、MIA、LUAD)进行平行处理和分析,极大提高了实验通量和数据产出效率。
标准化:所有样本在同一张玻片、同一轮实验、完全相同的处理条件下进行染色、探针杂交和测序,最大限度地减少了技术批次差异,保证了数据可比性。
这使得研究者能够用有限的珍贵样本资源,系统性地比较不同疾病阶段(从正常到癌)的细胞组成和空间结构,从而得出“促炎微环境随疾病进展而变化”这一关键结论。
3. 作为空间表型分析的理想平台,精确量化细胞邻域关系
研究的核心假设涉及特定细胞类型(如KACs、IL1B+巨噬细胞)在空间上的邻近关系。
每个TMA核心(通常直径1-1.5mm)包含了完整的微组织结构,是进行细胞邻域分析和生态位研究的完美单元。结合Xenium的高分辨率,研究者可以精确地计数在KACs或AAH细胞周围特定半径内,IL1B+巨噬细胞的数量,并进行统计学比较。可以系统地量化不同病变类型(AAH vs. AIS vs. LUAD)中,促炎细胞在其微环境中的富集程度。
这种方法提供了定量的、空间分辨的证据,直接支持了“上皮-促炎微环境是阶段特异性”的论点,而不仅仅是定性的描述。
简而言之,组织芯片在这项多模态空间组学研究中,扮演了从“初步发现”到“坚实结论”的桥梁角色(用Xenium验证了Visium的发现)。它将珍贵的临床样本转化为一个强大的、可控制的分析系统,使得研究者能够以高置信度验证、扩展并量化其在空间生物学上的核心发现。这种研究设计——用全组织切片进行探索性发现,再用TMA进行高通量验证——已成为现代肿瘤空间组学研究的黄金标准。
———————————————————————————————————————————————————————————————————————————————————————
空间多组学揭示了“细胞身份、微环境与空间定位”三位一体信息,为科研老师们理解疾病机制,精准医疗、发现新靶点提供了核心驱动力。为助力各位老师实现这一目标,芯超生物发布了产品“芯空一号”空间多组学解决方案,以期帮助大家走通 “从样本制备->数据挖掘"的全链条路径。
芯空一号
利用组织芯片/大组织切片,联合空间多组学技术、人工智能驱动的空间映射算法等创新方案,实现高性价比、高一致性、高维度的空间大数据挖掘与分析范式,是一种“从样本制备到数据挖掘”的全链条解决方案。它能够揭示意想不到的细胞互作关系,相同细胞类型在组织微环境中不同的细胞行为,识别不同的细胞聚集模式,预测疾病的发展。不仅可创新性地发现受空间限制的药物作用新靶标,更能通过建立三维病理特征-分子网络-临床表型的多维关联模型,为精准诊疗提供具有空间可解释性的新型生物标志物体系。

Visium空间转录组测序平台,CosMx™ SMI单细胞空间原位分子成像平台,GeoMx® DSP数字空间组学平台,PCF(PhenoCycler-Fusion)单细胞原位空间蛋白组平台,LCM+质谱-深度空间蛋白组平台,各空间多组学技术具有不同的技术参数,如细胞分辨率、基因覆盖率和通量,我们通过评估各平台的核心性能参数与实验兼容性,结合研究需求(如样本类型、研究规模及目标生物学问题),为研究者提供合理化的技术筛选框架,以实现精准匹配实验设计与平台能力。
期待与全国科研先锋并肩,以系统性解决方案重塑空间组学研究新范式,开启生命时空图谱的新纪元!如老师们有任何兴趣和问题,可随时联系芯超当地销售或拨打我们热线电话。祝老师们科研之路顺利!