上海芯超生物科技有限公司
19 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
公司新闻/正文
【空间多组学 IF: 48.5】应用实例文献合集
1632 人阅读发布时间:2025-12-24 10:19
在生命科学的最前沿,空间多组学正以日新月异的方式,为我们揭开生命复杂性的深层面纱。大家对“细胞身份、微环境与空间定位”三位一体信息的需求日益迫切,这不仅是理解疾病机制的关键,更是精准医疗、新靶点发现的核心驱动力。
科研学者们面对的不再是单一的技术路径,而是一个快速膨胀的“技术宇宙”:基于成像的方法能精确定位,但通量受限;基于测序的策略可全景扫描,却牺牲了部分分辨率。因此,“多模式整合”成为新趋势,分辨率和检测维度的权衡无处不在,而样本兼容性、数据分析复杂度、成本门槛更构成了现实挑战。当多种原理、各有优劣的平台并立于前,如何为独特的研究问题匹配“最优解”?

空间组学技术相继推出之后,各个疾病领域的科研工作者们都开始了组合的尝试与探索,并形成了多种多样的“研究程式”,其中最具代表性之一的就是“芯空一号”,即不同空间原位检测技术结合芯超特色组织芯片(TMA)的研究体系!今天小编就为大家整理了近3年来“芯空一号”的研究成果。
——————————————————————————————————————————————————————————————————————————————————————
文献一 IF:7.5

Journal of Translational Medicine ( IF 7.5 )
Pub Date : 2022-10-08
DOI: 10.1186/s12967-022-03661-8
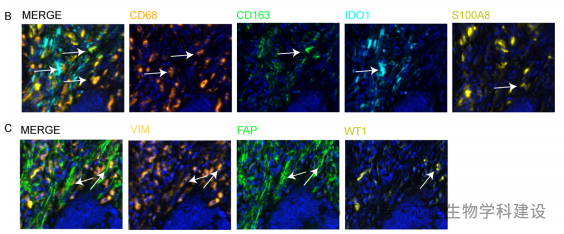
本研究通过整合单细胞RNA测序(scRNA-seq)、 bulk RNA-seq和组织芯片数据,系统解码了结直肠癌(CRC)的细胞生态系统。研究鉴定了7个上皮细胞功能亚群(如高侵袭性C4亚群),并发现肿瘤相关巨噬细胞(TAM)和癌症相关成纤维细胞(CAF)与C4细胞协同促进肿瘤进展。多色免疫组化验证了TAM/CAF与患者不良预后的关联。
空间转录组学(通过CIBERSORTx推断)揭示了C4上皮细胞与TAM/CAF在肿瘤组织中的空间共定位及配体-受体互作(如Wnt、TGF-β信号)。空间多组学数据明确了恶性细胞与微环境细胞的空间相互作用网络,为靶向TAM/CAF的联合策略提供依据。
——————————————————————————————————————————————————————————————————————————————————————
文献二 IF:12.5

Cell Discovery ( IF 12.5 )
Pub Date : 2023-09-19
DOI: 10.1038/s41421-023-00591-7
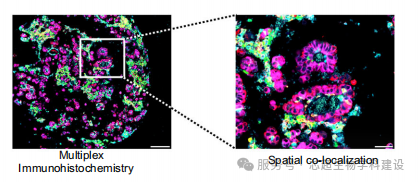
本研究结合空间转录组学和多重免疫组化,揭示了肺腺癌中不同组织学亚型(lepidic、micropapillary、solid等)的分子特征和细胞可塑性,发现微乳头亚型表现出显著的异质性和去分化状态。
空间转录组学明确了不同组织学亚型的空间分布特征,单细胞分析揭示了肿瘤细胞可塑性轨迹,为理解亚型转化提供空间维度证据。
——————————————————————————————————————————————————————————————————————————————————————
文献三 IF:6.2

Cell and Bioscience ( IF 6.2 )
Pub Date : 2024-02-04
DOI: 10.1186/s13578-024-01199-4
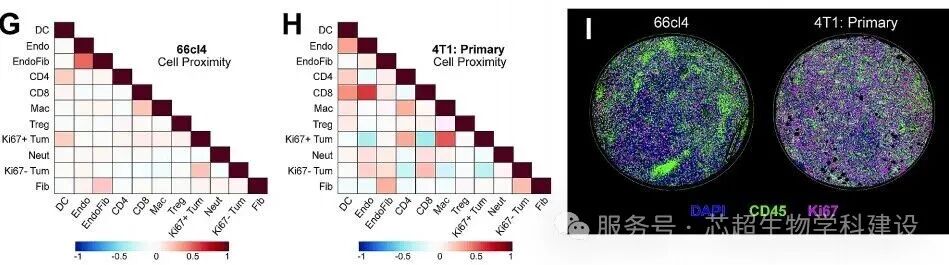
研究建立了可调谐的PhenoCycler(原CODEX)成像方案,解析了8种小鼠肿瘤模型的肿瘤微环境空间异质性,发现免疫细胞空间组织在免疫治疗耐药中发生改变。
PhenoCycler技术实现多重蛋白标志物的空间成像,为小鼠模型肿瘤微环境研究提供高内涵空间分析方法。
——————————————————————————————————————————————————————————————————————————————————————
文献四 IF:15.7

Nature Communications ( IF 15.7 )
Pub Date : 2024-03-29
DOI: 10.1038/s41467-024-46994-2
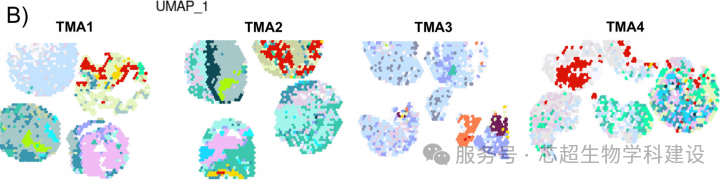
本研究利用单细胞RNA测序和空间转录组学技术,系统分析了胰腺导管内乳头状黏液性肿瘤(IPMN)从低度不典型增生(LGD)到高度不典型增生(HGD)直至胰腺导管腺癌(PDAC)的演进过程。研究揭示了上皮细胞的异质性(如HOXB3、SPDEF、NKX6-2等标记的不同亚型),并发现微环境中的免疫细胞(如巨噬细胞)和基质细胞在IPMN恶性转化中的动态变化。研究还强调MYC信号通路在IPMN进展中的激活作用。
空间转录组学(10x Visium技术)明确了IPMN不同病变区域(如LGD、HGD)的基因表达空间分布,验证了上皮亚型在组织中的定位(如HOXB3+细胞富集于HGD区域),并揭示了肿瘤与微环境相互作用的区域特异性(如免疫排斥现象)。空间多组学数据为IPMN的恶性转化机制提供了空间分辨率的证据。
——————————————————————————————————————————————————————————————————————————————————————
文献五 IF:27.6

Nature Immunology ( IF 27.6 )
Pub Date : 2024-08-23
DOI: 10.1038/s41590-024-01943-5
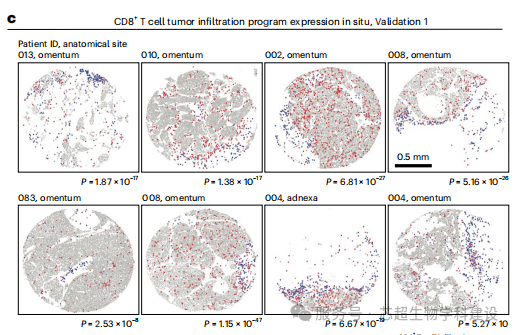
研究通过空间和扰动转录组学,鉴定出恶性细胞状态标志T细胞和NK细胞浸润水平,并发现PTPN1和ACTR8等基因扰动可诱导该状态,增强免疫细胞毒性。
空间转录组学结合CRISPR筛选,在空间分辨率下鉴定免疫调节因子,明确了恶性细胞状态与免疫细胞空间分布的关联。
——————————————————————————————————————————————————————————————————————————————————————
文献六 IF:28.5

Nature Cancer ( IF 28.5 )
Pub Date : 2024-09-26
DOI: 10.1038/s43018-024-00824-y
研究发现VIMhigh巨噬细胞与Treg细胞空间共定位促进免疫抑制,通过IL-1β增强Treg细胞功能,与免疫治疗反应相关。
PhenoCycler技术实现单细胞分辨率的空间蛋白组学分析,明确免疫细胞空间互作网络。

——————————————————————————————————————————————————————————————————————————————————————
文献七 IF:15.7

Nature Communications ( IF 15.7 )
Pub Date : 2024-11-16
DOI: 10.1038/s41467-024-54364-1
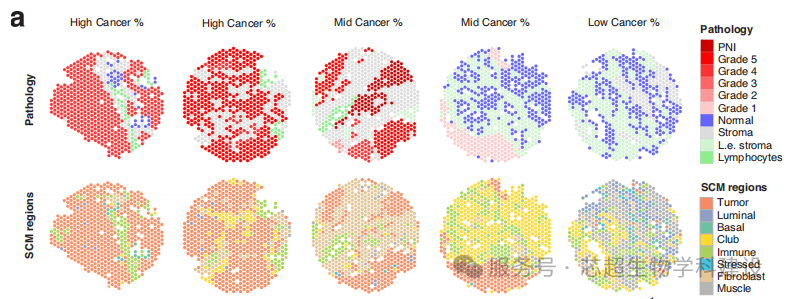
研究鉴定club样细胞作为前列腺上皮细胞亚型,具有衰老相关分泌表型,与PMN-MDSC活性增加相关,可能与去势抵抗性前列腺癌的发展有关。
空间转录组学结合单细胞测序,揭示了club样细胞与髓系细胞的空间相互作用。
——————————————————————————————————————————————————————————————————————————————————————
文献八 IF:12.5

Cell Discovery ( IF 12.5 )
Pub Date : 2025-01-28
DOI: 10.1038/s41421-024-00747-z
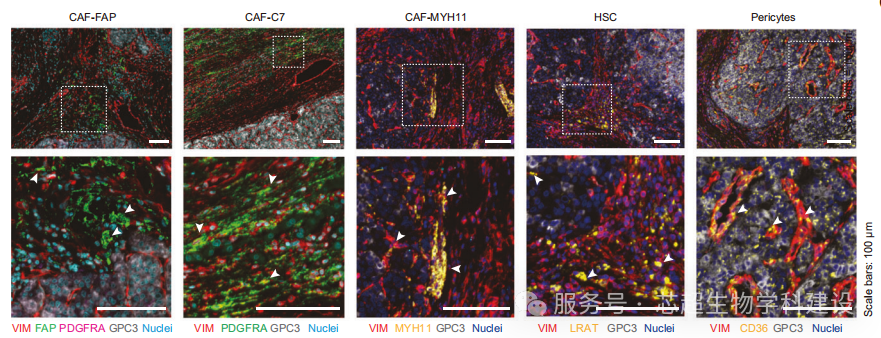
研究发现CAF-FAP和CAF-C7两个成纤维细胞亚群分别富集于肿瘤内基质和纤维环,其空间平衡决定临床预后,RUNX1和USF2分别调控其分化。
空间多组学分析揭示了CAF亚型在肿瘤空间微环境中的特异分布,单细胞测序明确了其发育轨迹和转录调控网络。
——————————————————————————————————————————————————————————————————————————————————————
文献九 IF:29

Nature Genetics ( IF 29 )
Pub Date : 2025-02-03
DOI: 10.1038/s41588-025-02080-x
研究利用空间转录组学分析肺纤维化的分子生态位,发现肺泡上皮失调和巨噬细胞极化是疾病进展的关键事件。
空间转录组学结合机器学习方法,在肺泡空间分辨率下量化重构严重程度。

——————————————————————————————————————————————————————————————————————————————————————
文献十 IF:7.4

Cellular and Molecular Gastroenterology and Hepatology ( IF 7.4 )
Pub Date : 2025-05-20
DOI: 10.1016/j.jcmgh.2025.101536
研究发现HBP1在急性胰腺炎中起保护作用,但在致癌KRAS存在时促进胰腺上皮内瘤变发生发展,具有双重功能。
空间转录组学解析了HBP1在胰腺不同病理状态下的空间表达模式。
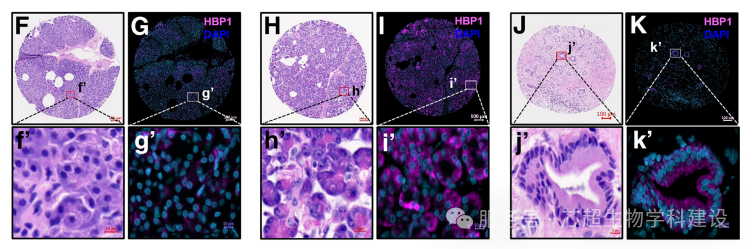
——————————————————————————————————————————————————————————————————————————————————————
文献十一 IF:10.6

Journal for ImmunoTherapy of Cancer ( IF 10.6 )
Pub Date : 2025-07-10
DOI: 10.1136/jitc-2024-011319
本研究通过scRNA-seq和空间转录组学(GeoMx DSP技术)分析膀胱癌患者对新辅助免疫检查点抑制剂(nICB)的耐药机制。研究发现MYBL2高的癌症干细胞(CSC)与SPP1+巨噬细胞形成“恶性联盟”,通过CCL15-CCR1/SPP1-ITGα9β1信号轴促进免疫抑制微环境,导致CD8+T细胞排斥和免疫治疗耐药。动物实验证实靶向MYBL2和SPP1可增强抗PD-1疗效。
空间转录组学解析了肿瘤微环境中MYBL2hi CSC与SPP1+巨噬细胞的空间共定位关系,并显示二者互作驱动T细胞排斥。空间数据还验证了耐药患者肿瘤中免疫抑制信号(如T细胞衰竭标记物)的空间分布特征,为靶向干预提供空间依据。
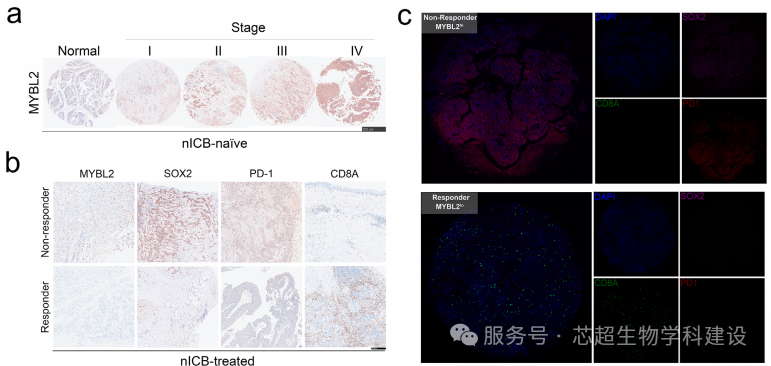
——————————————————————————————————————————————————————————————————————————————————————
文献十二 IF:48.5

Nature ( IF 48.5 )
Pub Date : 2025-08-20
DOI: 10.1038/s41586-025-09370-8
本研究揭示了癌症诱导的神经损伤(CINI)是抗PD-1治疗耐药的新机制。通过scRNA-seq、空间转录组学和电镜分析,发现肿瘤细胞通过降解髓鞘直接损伤神经元,触发神经元内ATF3/JUN介导的IL-6和I型干扰素炎症反应,招募免疫抑制性巨噬细胞并耗竭T细胞,最终导致免疫治疗耐药。动物实验表明,阻断神经元损伤信号(如敲除Atf3或靶向IL-6R)可恢复抗PD-1疗效。
空间转录组学(GeoMx DSP和Visium技术)明确了损伤神经元(ATF3+)与免疫细胞(如CD163+巨噬细胞)在肿瘤神经侵袭(PNI)区域的空间共定位,并显示CINI相关炎症信号在肿瘤微环境中的梯度分布。空间多组学数据直观展示了神经-免疫互作的空间网络,为CINI驱动耐药提供了空间证据。
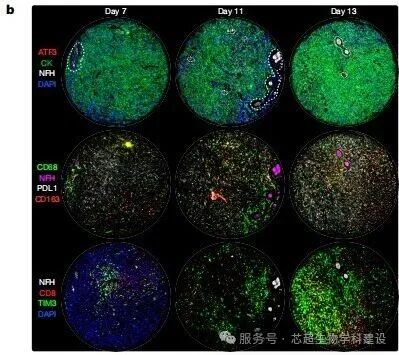
——————————————————————————————————————————————————————————————————————————————————————
文献十三 IF:33.9

Molecular Cancer ( IF 33.9 )
Pub Date : 2025-11-06
DOI: 10.1186/s12943-025-02490-9
研究发现在H. pylori阳性胃癌中,THBS1+ CAFs通过WNT5-FZD相互作用招募Treg细胞,而ZFP36通过降解FN1 mRNA抑制CTL活化,共同促进免疫抑制。
空间转录组学与单细胞RNA测序结合,揭示了CAF亚型与免疫细胞的空间相互作用网络。
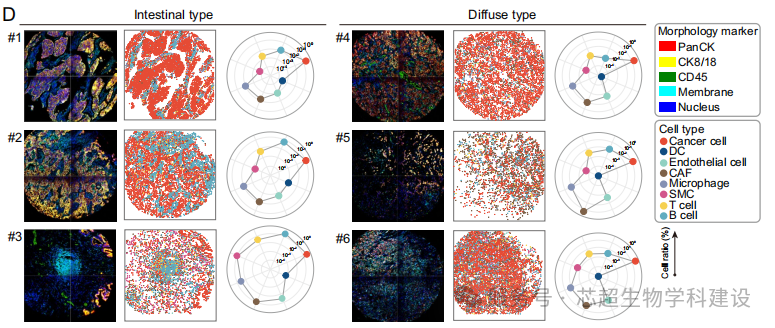
———————————————————————————————————————————————————————————————————————————————————————
空间多组学揭示了“细胞身份、微环境与空间定位”三位一体信息,为科研老师们理解疾病机制,精准医疗、发现新靶点提供了核心驱动力。为助力各位老师实现这一目标,芯超生物发布了产品“芯空一号”空间多组学解决方案,以期帮助大家走通 “从样本制备->数据挖掘"的全链条路径。
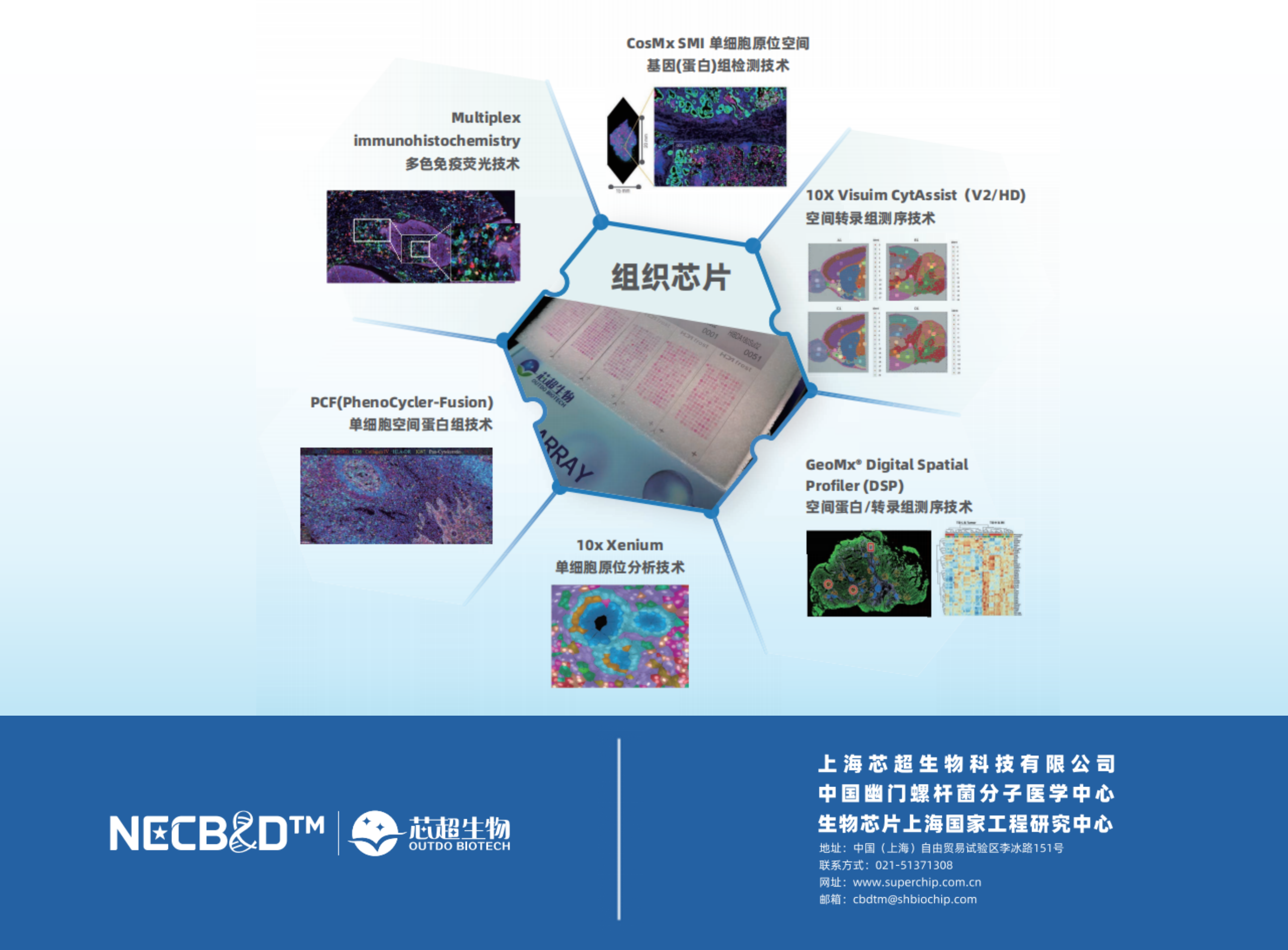
芯空一号
利用组织芯片/大组织切片,联合空间多组学技术、人工智能驱动的空间映射算法等创新方案,实现高性价比、高一致性、高维度的空间大数据挖掘与分析范式,是一种“从样本制备到数据挖掘”的全链条解决方案。它能够揭示意想不到的细胞互作关系,相同细胞类型在组织微环境中不同的细胞行为,识别不同的细胞聚集模式,预测疾病的发展。不仅可创新性地发现受空间限制的药物作用新靶标,更能通过建立三维病理特征-分子网络-临床表型的多维关联模型,为精准诊疗提供具有空间可解释性的新型生物标志物体系。

Visium空间转录组测序平台,CosMx™ SMI单细胞空间原位分子成像平台,GeoMx® DSP数字空间组学平台,PCF(PhenoCycler-Fusion)单细胞原位空间蛋白组平台,LCM+质谱-深度空间蛋白组平台,各空间多组学技术具有不同的技术参数,如细胞分辨率、基因覆盖率和通量,我们通过评估各平台的核心性能参数与实验兼容性,结合研究需求(如样本类型、研究规模及目标生物学问题),为研究者提供合理化的技术筛选框架,以实现精准匹配实验设计与平台能力。
期待与全国科研先锋并肩,以系统性解决方案重塑空间组学研究新范式,开启生命时空图谱的新纪元!如老师们有任何兴趣和问题,可随时联系芯超当地销售或拨打我们热线电话。祝老师们科研之路顺利!